 重要提示:
请勿将账号共享给其他人使用,违者账号将被封禁!
重要提示:
请勿将账号共享给其他人使用,违者账号将被封禁!
题目
在600℃,100kPa时下列反应达到平衡:
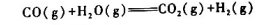
现在把压力提高到5×104kPa,问:
(1)若各气体均视为理想气体,平衡是否移动?
(2)若各气体的逸度因子分别为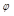 (CO2)=1.09,
(CO2)=1.09,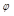 (H2)=1.10,
(H2)=1.10,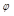 (CO)=1.20,
(CO)=1.20,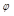 (H2O)=0.75,与理想气体反应相比,平衡向哪个方向移动?
(H2O)=0.75,与理想气体反应相比,平衡向哪个方向移动?
 更多“在600℃,100kPa时下列反应达到平衡:现在把压力提高到5×104kPa,问:(1)若各气体均视为理想”相关的问题
更多“在600℃,100kPa时下列反应达到平衡:现在把压力提高到5×104kPa,问:(1)若各气体均视为理想”相关的问题
第1题
已知在298K和100kPa压力下,反应CO(g)+H2O(g) CO2(g)+H2(g),将各气体视为理想气体,试计算:
CO2(g)+H2(g),将各气体视为理想气体,试计算:
(1)298K下反应的;
(2)596K、500kPa下反应的△rHm、△rSm;
(3)596K下反应的。需要的热力学数据如△fHm、、Cp,m请从附录的数据表中查阅。

第2题
有10mol的气体(设为理想气体),压力为1000kPa,温度为300K,分别求出等温时下列过程的功。
(1)在空气压力为100kPa时,体积胀大1dm3;
(2)在空气压力为100kPa时,膨胀到气体压力也是100kPa;
(3)等温可逆膨胀至气体的压力为100kPa。
第3题
反应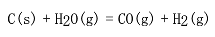 在1000K达到平衡时,系统总压力为100kPa,H2O(g)的转化率为84.4%。试求该温度下反应的
在1000K达到平衡时,系统总压力为100kPa,H2O(g)的转化率为84.4%。试求该温度下反应的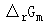 。
。
第4题
A.发信-4dBr,600Ω(平衡型)收信-7dBr,600Ω(平衡型)
B.发信-4dBr,600Ω(平衡型)收信-10dBr,600Ω(平衡型)
C.发信0dBr,600Ω(平衡型)收信-10dBr,600Ω(平衡型)
D.发信0dBr,600Ω(平衡型)收信-7dBr,600Ω(平衡型)
第5题
若将1.00mol SO2(g)和1.00molO2(g)的混合物,在600℃和100kPa下缓慢通过V2O5催化剂,使生成SO3(g)。当达到平衡后总压仍为100kPa,测得混合物中剩余的O2为0.615mol。试计算标准平衡常数KΘ(873K)。
第6题
产生水煤气的反应为C(s)+H2O(g)====CO(g)+H2(g),各气体分压均处在100kPa下,体系达到平衡,求体系的温度。已知各物质的热力学数据如下:
| CO(g) | H2O(g) | |
| △_{f}H_{m}^{ominus }(298.15K)/kJ·mol-1 | -110.5 | -241.8 |
| △_{f}G_{m}^{ominus }(298.15K)/kJ·mol-1 | -137.2 | -228.6 |
第8题
反应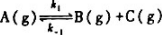 中,k1和k-1,在25℃时分别为0.2s-1和.3.9477x10-3MPa-1.s-1.在35℃时二者皆增为2倍.试求:
中,k1和k-1,在25℃时分别为0.2s-1和.3.9477x10-3MPa-1.s-1.在35℃时二者皆增为2倍.试求:
(1)25C时的反应平衡常数Kθ;
(2)正、逆反应的活化能及25℃时的反应热Qm;
(3)若上述反应在25℃的恒容条件下进行,且A的起始压力为100kPa,若要使总压达到152kPa,问需要反应多长时间?
第9题
反应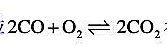 在2800K、101325Pa下达到平衡,平衡常数
在2800K、101325Pa下达到平衡,平衡常数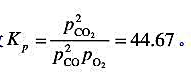 求:
求:
(1)这时的离解度及各气体的分压力;
(2)在相同温度下,下列两反应各自的平衡常数.
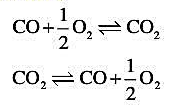
第10题
300K时,9.20gN2O4(g)按反应N2O4(g) 2NO2(g)分解,达平衡时,系统体积为3.00dm3,压力为100kPa。
2NO2(g)分解,达平衡时,系统体积为3.00dm3,压力为100kPa。
第11题
时,平衡向气体分子数()的方向移动。如气体反应前后分子数无变化时,则增加压力对平衡()。

 警告:系统检测到您的账号存在安全风险
警告:系统检测到您的账号存在安全风险
为了保护您的账号安全,请在“赏学吧”公众号进行验证,点击“官网服务”-“账号验证”后输入验证码“”完成验证,验证成功后方可继续查看答案!
